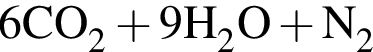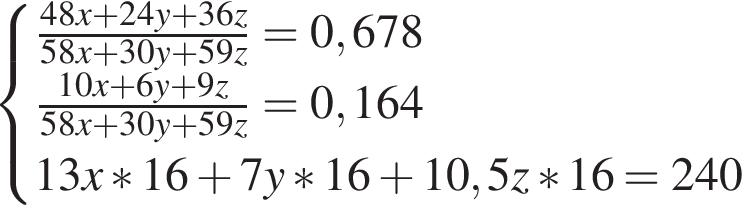В четырёх пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
— вещества из пробирок 1 и 4 нейтрализуют друг друга;
— вещества из пробирок 3 и 4 реагируют между собой с образованием осадка, который растворяется как в кислотах, так и в щелочах;
— при добавлении к содержимому пробирки 2 вещества из пробирки 4 образуется осадок, который на воздухе приобретает бурую окраску.
Установите соответствие между названием неорганического вещества и номером пробирки, в которой находится раствор данного вещества.
НАЗВАНИЕ ВЕЩЕСТВА
А) сульфат цинка
Б) азотная кислота
В) хлорид железа(II)
Г) гидроксид натрия
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б4В3Г1.
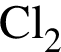
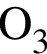
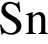
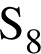
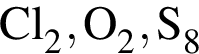 являются молекулами, а не символами. Символы химических элементов представлены в таблице Менделеева.
являются молекулами, а не символами. Символы химических элементов представлены в таблице Менделеева.
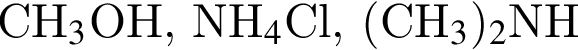
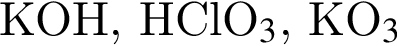
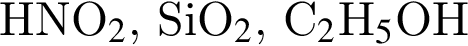
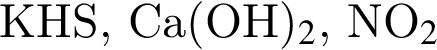
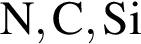
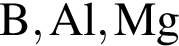
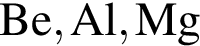
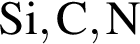
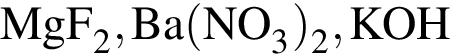
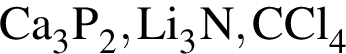
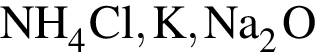
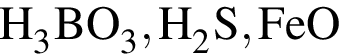
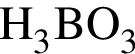 ковалентые полярные. Следовательно, подходит только первый вариант ответа.
ковалентые полярные. Следовательно, подходит только первый вариант ответа.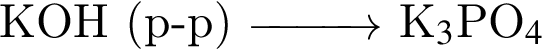 можно использовать вещество, формула которого:
можно использовать вещество, формула которого: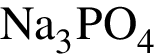 (р-р)
(р-р)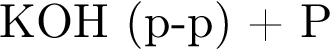 не пойдёт
не пойдёт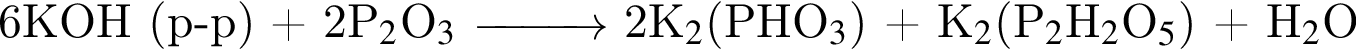
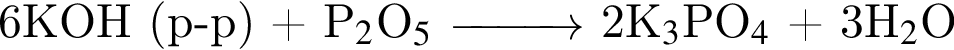
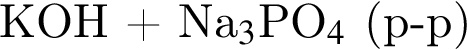 не пойдёт, поскольку в результате не образуется ни осадок, ни газ, ни слабый электролит.
не пойдёт, поскольку в результате не образуется ни осадок, ни газ, ни слабый электролит.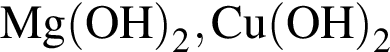
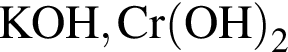
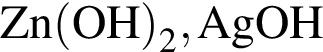
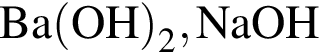
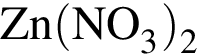
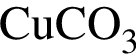

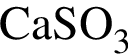
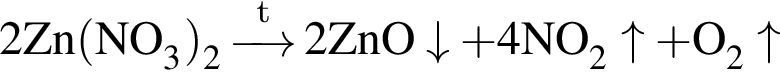 .
.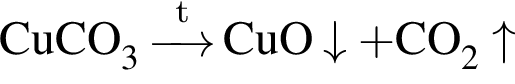
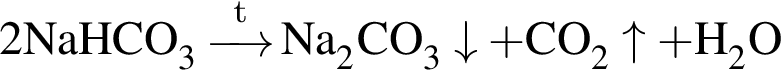
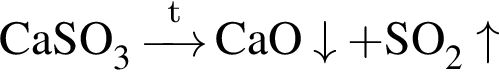
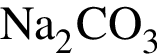 ) = 53 г (из 1 моль
) = 53 г (из 1 моль 
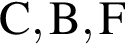
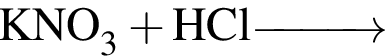
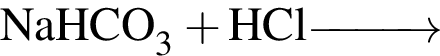
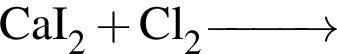
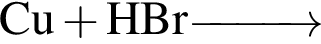
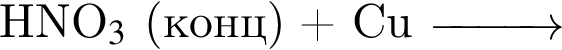
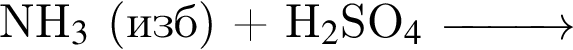
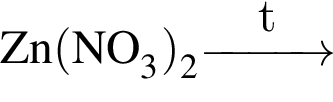
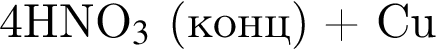 - 4+1 следовательно, 5
- 4+1 следовательно, 5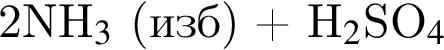 - 2+1 следовательно, 3
- 2+1 следовательно, 3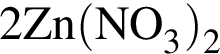 коэффициент 2
коэффициент 2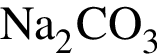
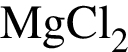
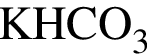
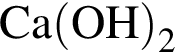
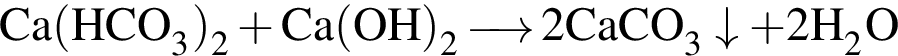 .
.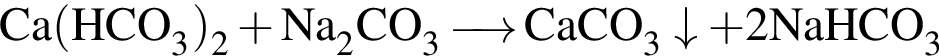 .
.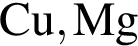
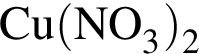
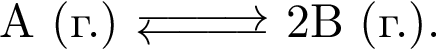
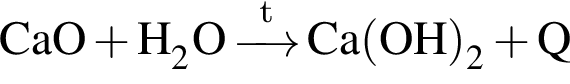 .
.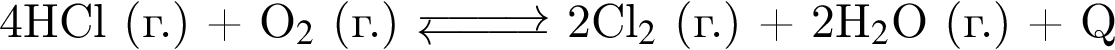 :
: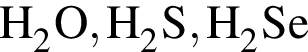 наибольшую температуру кипения имеет
наибольшую температуру кипения имеет 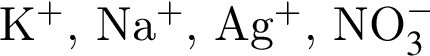
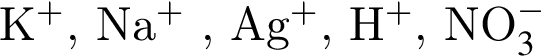
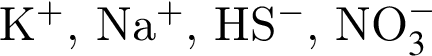
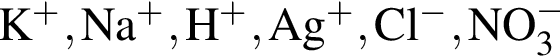
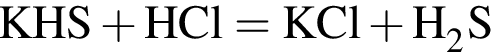 ↑
↑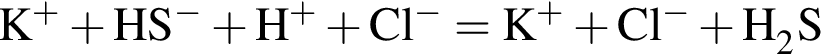 ↑
↑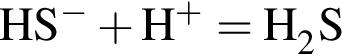 ↑
↑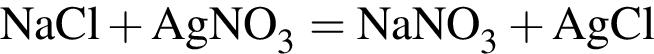 ↓
↓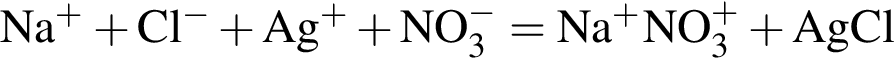 ↓
↓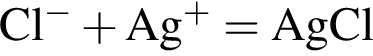 ↓
↓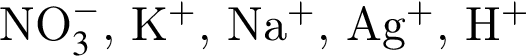 . Присутствие ионов серебра и водорода обуславливается добавлением избытков раствора нитрата серебра(I) и соляной кислоты к смеси.
. Присутствие ионов серебра и водорода обуславливается добавлением избытков раствора нитрата серебра(I) и соляной кислоты к смеси.
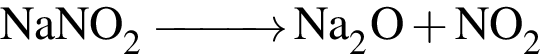
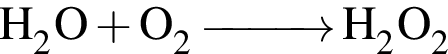
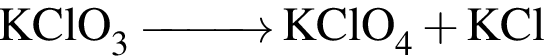
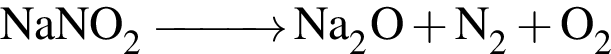
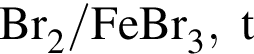
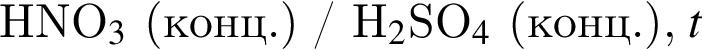
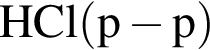
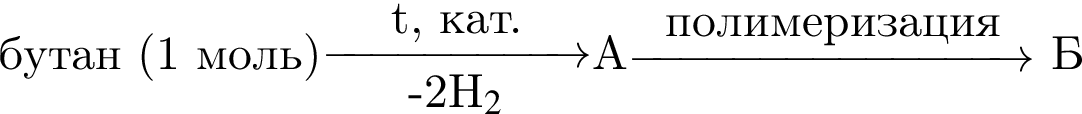
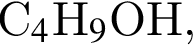 которые можно окислить до соответствующих карбоновых кислот состава
которые можно окислить до соответствующих карбоновых кислот состава 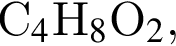 равно:
равно: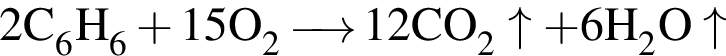 .
.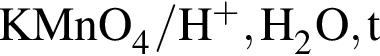
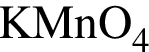 , окисляясь до уксусной кислоты. Схема реакции:
, окисляясь до уксусной кислоты. Схема реакции: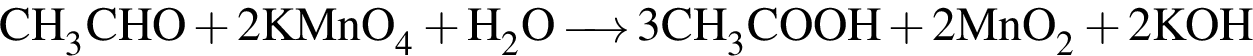 .
.
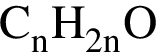
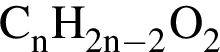
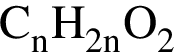
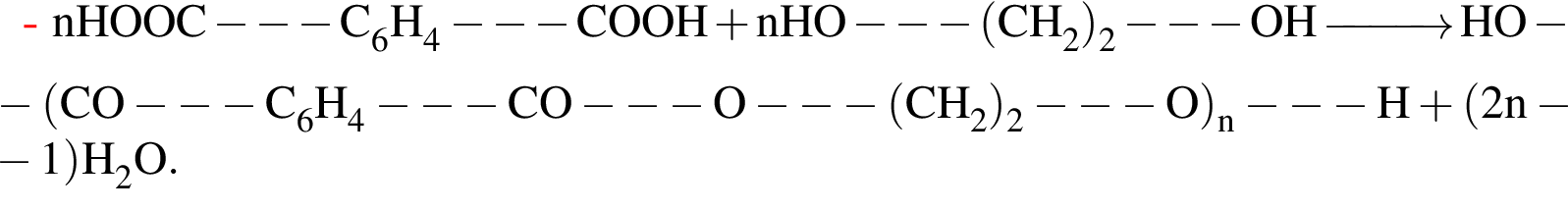
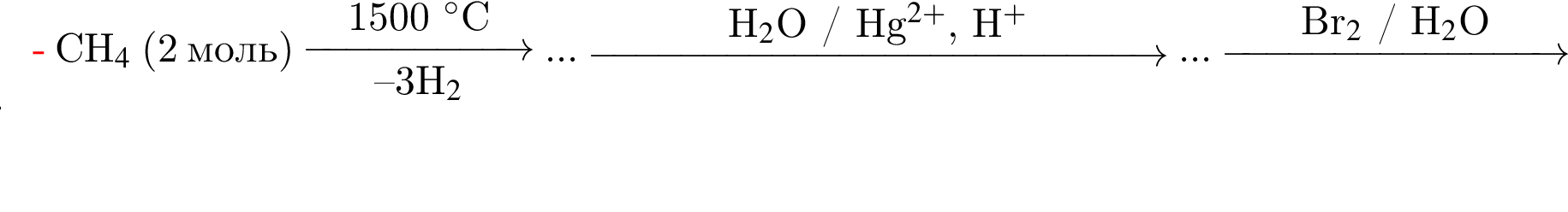
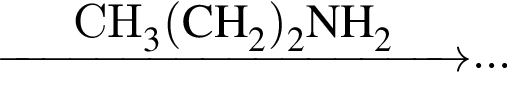
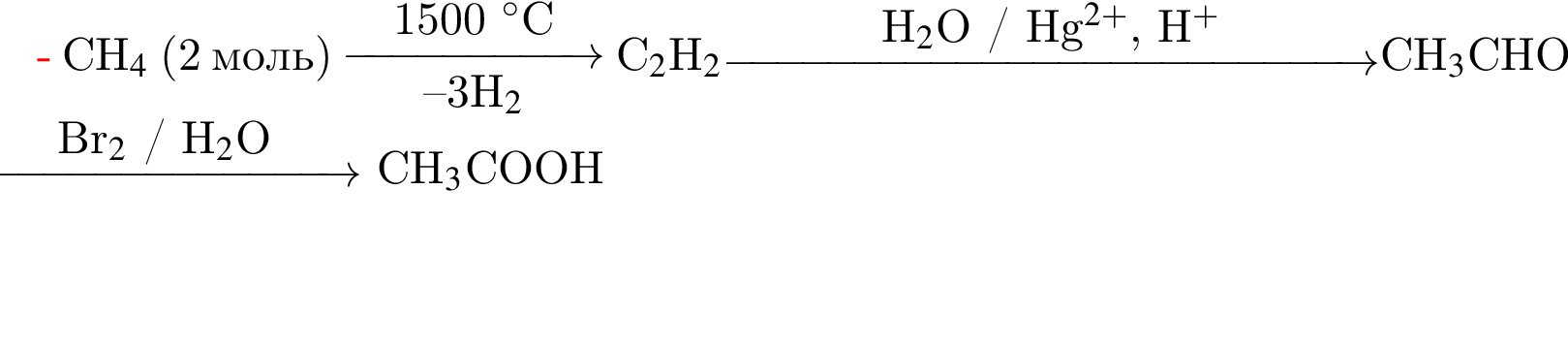
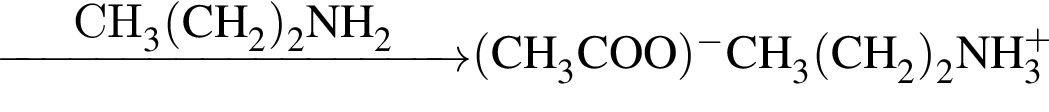
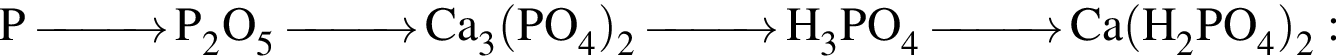
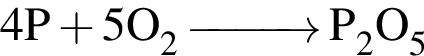

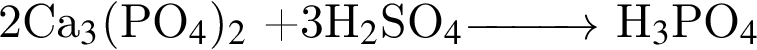
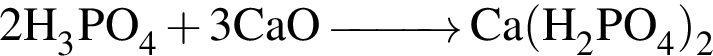

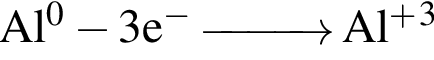
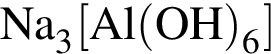 )=1782 г/198 г/моль=9 моль
)=1782 г/198 г/моль=9 моль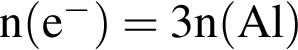 =27 моль
=27 моль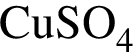 содержится чистого вещества 24*0.08=1.92 г
содержится чистого вещества 24*0.08=1.92 г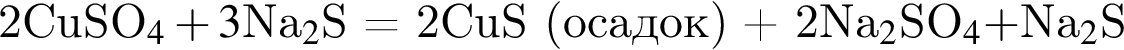
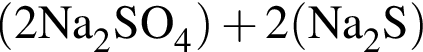 = 6 моль,
= 6 моль,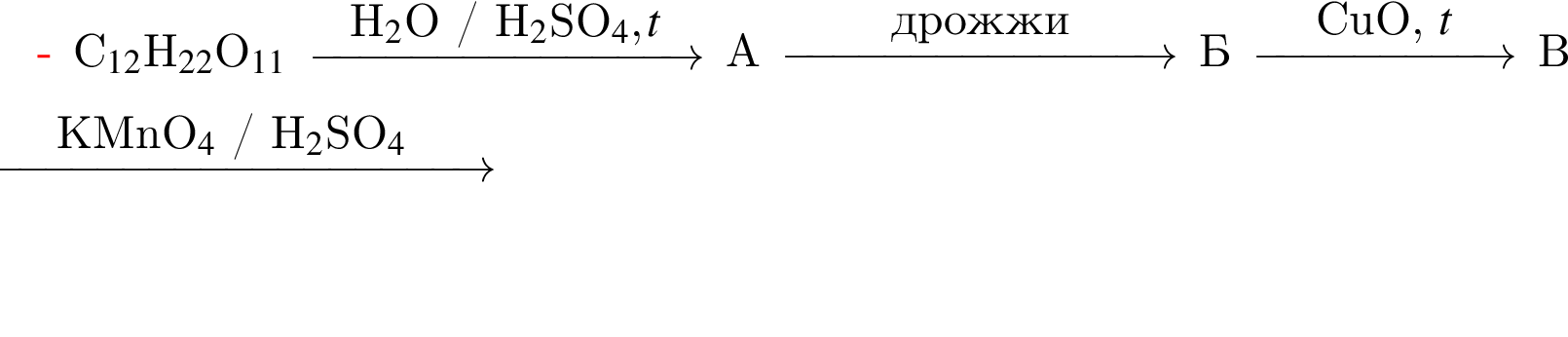
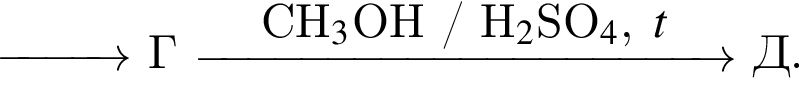
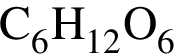 .
.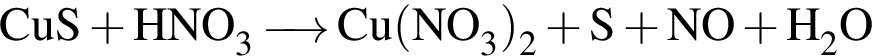
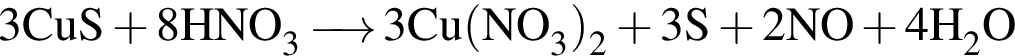
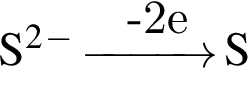
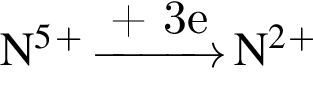
 и
и 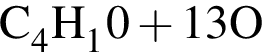 →
→ 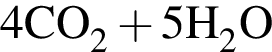
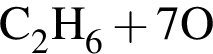 →
→ 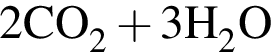
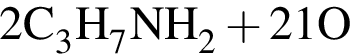 →
→